یون سولفات یک آنیون چند اتمی با فرمول تجربی SO2-4 است. سولفات پیشنهاد IUPAC می باشد. نمک ها، مشتقات اسیدی و پراکسید های سولفات به طور گسترده در صنعت و همین طور زندگی روزمره استفاده میشوند.
سولفات ها نمک های اسید سولفوریک هستند و بسیاری از آنها از اسید سولفوریک به دست میآیند.ساختارآنیون سولفات از یک اتم مرکزی گوگرد تشکیل شده که توسط چهار اتم اکسیژن هم ارز در یک آرایش تتراهدرال احاطه شده است. در اینجا اتم گوگرد عدد اکسایش ۶+ و هر یک از اتم های اکسیژن عدد اکسایش ۲- دارند. یون سولفات به طور کلی بار ۲- دارد و باز مزدوج یون بی سولفات (یا هیدروژن سولفات)، HSO-4 می باشد که آن هم خود باز مزدوج اسید سولفوریک H2SO4 است. استرهای سولفات آلی مثل سولفات دی متیل، ترکیبات کوالانسی هستند که استرهای اسید سولفوریک به حساب میآیند. هندسه مولکولی تتراهدرال یون سولفات به کمک تئوری وسپر (VSEPR) پیش بینی شده است.
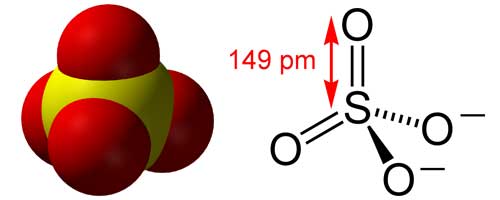
پیوند شیمیایی اولین توصیف پیوند شیمیایی در اصطلاحات جدید در مقاله گیلبرت لویس (Gillbert Lewis) در ۱۹۱۶ بود که عبارتست از این که در اطراف هر اتم آرایش الکترونی باید آرایش اکتت یا هشتایی باشد که این تعریف پیوند های دوگانه و بار ۲+ را برای اتم گوگرد توضیح نمیدهد. بعد از این لینوس پائولینگ (Linus Pauling) تئوری پیوند والانس را مطرح کرد که در آن اشاره می کند دو پیوند شیمیایی پای (pi یا π) اوربیتال های d را نیز درگیر میکند. استدلال او به این صورت بود که باری که بر روی گوگرد وجود دارد طبق اصل خنثی بودن اتم کاهش یافته است. طول پیوند S-O که ppm 149 است نسبت به طول پیوند S-OH در اسید سولفوریک که حدود ppm 157 است کوتاه تر است. پائولینگ طول پیوند دوگانه را به کوتاهی پیوند S-O در نظر گرفت.
استفاده پائولینگ از اوربیتال d باعث شد مباحثاتی بر روی اهمیت نسبی پیوند پای (pi یا π) و قطبیت پیوند (جاذبه الکترواستاتیکی) در کاهش دادن طول پیوند S-O شود. نتیجه اتفاق نظرها منجر به این نظر شد که اوربیتال های d در این میان نقشی دارند ولی اهمیت آنها کمتر از چیزی است که پائولینگ ادعا نموده بود.توصیفی از پیوند πPπ-dπتوسط دی دبلیو جی کروک شانک (D.W.J Cruickshank) پیشنهاد شده است که به طور گسترده پذیرفته شده است.
در این مدل، اوربیتال های P پر شده اکسیژن به اوربیتال های d خالی گوگرد همپوشانی میکند. با این وجود، در این توصیف با وجود اینکه برای پیوندهای S-O برخی ویژگیهای پیوند π در نظر گرفته شده است. این پیوند به طور چشمگیری ویژگیهای پیوندهای یونی را دارد. برای سولفوریک اسید، آنالیز محاسباتی یک بار مثبت واضح بر روی گوگرد (۲٫۴۵+) و اشغال املاک اربیتال ۳d را تایید می کند. بنابراین ساختاری که ۴ پیوند یگانه را نشان می دهد یک ساختار لوئیس بهینه شده است که در آن پیوندهای دوگانه نشان داده نشده است. در این مدل، ساختار از قانون اکتت (هشت تایی) تبعیت میکند و توزیع بار آن با الکترونگاتیوی اتم ها همخوان دارد.
ناهماهنگی بین طول پیوند S-O در یون سولفات و طول پیوند S-OH در اسید سولفوریک به این شکل توضیح داده می شود که پیوندهای شیمیایی S=O در اسید سولفوریک الکترونهای اوربیتال P خود به اوربیتال های ضد پیوندی S-OH دادهاند و ضعیف شدهاند، پس طول پیوند به آنها نسبت به قبل افزایش یافته است.با این وجود، در بسیاری از متون علمی برای سولفات و سایر ترکیبات گروه اصلی با اکسیژن مدل پائولینگ ارائه می شود .
اگر بتوان تشخیص داد که پیوندهای دوگانه کووالانسی در ساختار لوئیس، در واقع پیوندهایی را نشان میدهد که بیش از ۹۰ درصد قطبی شده و به سمت اکسیژن رفته اند یک تناقض آشکار روشن خواهد شد. به عبارت دیگر، در یک ساختار با یک پیوند یونی بار به صورت جفت الکترون تنها روی اکسیژن مستقر شده است.روش های تولید سولفات فلزی به شرح زیر است:• اضافه کردن آهن، آهن هیدروکسید یا اکسید آهن به اسید سولفوریکZn + H2SO4 –> ZnSO4 + H2
Cu(OH)2 + H2SO4 –> CuSO5 + 2H2O
dCO3 + H2SO4 –> CdSO4 + H2O + CO2• اکسیداسیون سولفید آهنویژگی ها:تعداد زیادی از سولفات های یونی شناخته شده اند و تعدادی از آنها در آب بسیار محلول هستند. استثنائات عبارتند از سولفات کلسیم، سولفات استرانسیم ، سولفات سرب (II) سولفات باریم که انحلال پذیری ضعیفی دارند. نامحلول ترین سولفات شناخته شده سولفات رادیوم است. مشتقات باریم در آنالیزهای وزن سنجی سولفات مفید است. اگر محلول کلرید باریم به محلولی حاوی یون های سولفات اضافه شود رسوبات سفید تشکیل شده سولفات باریم است.یون سولفات میتوانند نقش یک لیگاند را بازی کنم که هم به اکسیژن (تک دندانه) و هم به دو اکسیژن و هم میتواند پل بسازد.
یک مثال از آن کمپلکس [Co(en)2(SO4)]+Br-[7] و یا کمپلکس فلزی خنثی PtSO4(P(C6H5)3)2 است، که در آن یون سولفات به عنوان یک لیگاند دودندانه است. پیوندهای اکسیژن-فلز در کمپلکس های سولفات ویژگی های کووالانسی دارند.
کاربرد های سولفات
سولفات ها به طور گسترده مصرف صنعتی دارند. ترکیبات اصلی شامل موارد زیر است:
گچ یک ماده معدنی طبیعی است که از سولفات کلسیم هیدراته تشکیل شده است و برای تولید پلاستر استفاده میشود. سالیانه ۱۰۰ میلیون تن در صنعت ساختمان مصرف میشود.
سولفات مس یک جلبک کش رایج است که فرم پایدار آن CuSO4 در سلول های گالوانی به صورت الکترولیت استفاده میشود.
سولفات آهن نوعی از مکمل های معدنی برای انسان، حیوان و خاک است.
سولفات منیزیم به عنوان نمک اپسوم شناخته میشود و در حمام های درمانی استفاده می شود.
سولفات سرب در هر صفحه تخلیه بار باتری سر- اسید به کار می رود
سولفات سدیم با گرید و خلوص مختلف در صنایع مختلفی همچون شیشه سازی، دارو سازی، بافندگی ، مواد شوینده و …. کاربرد فراوان دارد.
سولفات آلومینیوم عمده مصرف آلومینیوم سولفات به عنوان عامل منعقد کننده در تصفیه آب آشامیدنی می باشد.
031-32615691
031-32615693
ساعات کاری از شنبه تا چهارشنبه 8:30 تا 16:30 و پنج شنبه ها 8:30 الی 12:30
شماره تلفن همراه جهت پیشنهادات و انتقاد ها:
0912-730-9439
 صدرا شیمی فروشنده مواد اولیه شیمیایی صنعتی و مواد اولیه شوینده
صدرا شیمی فروشنده مواد اولیه شیمیایی صنعتی و مواد اولیه شوینده